Käsite hybridisaatio määritellään prosessiksi, jossa yhdistetään kaksi atomikiertorataa uudentyyppisten hybridisoitujen kiertoradojen luomiseksi. Tämä sekoittuminen johtaa tyypillisesti hybridiorbitaalien muodostumiseen, joilla on täysin erilaiset energiat, muodot ja niin edelleen. Hybridisaatio tapahtuu ensisijaisesti saman energiatason atomikiertoradalla. Kuitenkin sekä täysin täytetyt että puolitäytetyt orbitaalit voivat osallistua tähän prosessiin, jos niiden energiat ovat yhtä suuret. Hybridisaation käsite on valenssisidosteorian laajennus, joka auttaa meitä ymmärtämään sidoksen muodostumista, sidosenergioita ja sidosten pituuksia.
Mikä on hybridisaatio?
Kun kaksi atomiorbitaalia yhdistyvät muodostaen hybridiradan molekyylissä, yksittäisten atomien kiertoradan energia jakautuu uudelleen antamaan vastaavan energian kiertoradat. Tätä kutsutaan hybridisaatioksi.
Vertailukelpoisten energioiden atomiorbitaalit sekoittuvat toisiinsa hybridisaatioprosessin aikana, joka sisältää useimmiten kahden orbitaalin tai kahden 'p'-orbitaalin yhdistämisen tai 's'-orbitaalin sekoittamisen 'p'-orbitaaliin sekä 's'-orbitaaliin. kiertoradalla 'd'-orbitaalilla.
Hybridiradat ovat uudet kiertoradat, jotka muodostuvat tämän prosessin seurauksena. Vielä tärkeämpää on, että hybridiorbitaaleja voidaan käyttää atomisidosominaisuuksien ja molekyyligeometrian selittämiseen. Hiili esimerkiksi muodostaa neljä yksittäistä sidosta, joissa valenssikuoren kiertorata yhdistyy kolmen valenssikuoren p-orbitaaliin. Tämä yhdistelmä tuottaa neljä ekvivalenttia sp3seokset. Ne järjestetään tetraedrisiksi hiilen ympärille, joka on sitoutunut neljään eri atomiin.
Vaiheet hybridisaation tyypin määrittämiseksi
Atomin tai ionin hybridisaation tyypin ymmärtämiseksi on noudatettava seuraavia sääntöjä.
- Määritä ensin atomin tai ionin sisältämien valenssielektronien kokonaismäärä.
- Laske sitten kyseiseen atomiin tai ioniin kiinnittyneiden yksinäisten parien lukumäärä.
- Nyt tarvittavien kiertoratojen määrä voidaan laskea lisäämällä dupleksien tai oktetin lukumäärä ja yksinäisten elektroniparien lukumäärä.
- On huomattava, että atomien tai ionien kiertoradan geometria on erilainen, kun ei ole olemassa yksinäistä elektroniparia.
Hybridisaation ominaisuudet
- Hybridisaatio tapahtuu atomiorbitaalien välillä, joilla on sama energia.
- Muodostettujen hybridiorbitaalien lukumäärä on yhtä suuri kuin sekoittuneiden atomiorbitaalien lukumäärä.
- Kaikkien puoliksi täytettyjen orbitaalien ei tarvitse osallistua hybridisaatioon. Jopa kokonaan täytetty, mutta hieman vaihteleva energia omaavat kiertoradat voivat osallistua.
- Hybridisaatio tapahtuu vain sidoksen muodostumisen aikana, ei yhdessä kaasumaisessa atomissa.
- Jos molekyylin hybridisaatio tunnetaan, molekyylin muoto voidaan ennustaa.
- Hybridiorbitaalin suurempi keila on aina positiivinen, kun taas pienempi keila vastakkaisella puolella on aina negatiivinen.
Tyypit Hybridisaatiosta
Hybridisaatio voidaan luokitella sp3, sp2, sp., sp3d, sp3d2, tai sp3d3sekoitukseen osallistuvien orbitaalien tyyppien perusteella.
sp Hybridisaatio
Se tapahtuu, kun yksi s ja yksi p-orbitaali atomin pääkuoressa yhdistyvät muodostaen kaksi uutta vastaavaa kiertorataa. Äskettäin muodostuneet kiertoradat tunnetaan sp-hybridisoituneina orbitaaleina. Se tuottaa lineaarisia molekyylejä 180° kulmassa. Se edellyttää oman kiertoradan ja yhtä energiaa olevan 'p'-radan yhdistämistä uuden hybridiradan tuottamiseksi, joka tunnetaan nimellä sp-hybridisoitu orbitaali.
lajiteltu arraylist java
- Se tunnetaan myös diagonaalihybridisaationa.
- Jokainen sp-hybridisoitu orbitaali sisältää saman määrän s- ja p-merkkejä.
- Kaikki berylliumyhdisteet, kuten BeF2, Hyvin2ja BeCl2, ovat esimerkkejä.

sp2Hybridisaatio
Se tapahtuu, kun saman atomin kuoren yksi s- ja kaksi p-orbitaalia yhdistyvät muodostaen kolme ekvivalenttia orbitaalia. Äskettäin muodostuneet kiertoradat tunnetaan nimellä sp2hybridiradat. Se tunnetaan myös trigonaalisena hybridisaationa. Se edellyttää oman kiertoradan yhdistämistä kahteen yhtä energiaa olevaan 'p'-kiertoradaan uuden hybridiradan luomiseksi, joka tunnetaan nimellä sp2. S- ja p-orbitaalien trigonaalinen symmetria-seos pidetään 120 asteessa. Kaikki kolme hybridiorbitaalia pysyvät samassa tasossa ja muodostavat 120° kulman keskenään.
- Jokaisella muodostuneella hybridiradalla on 33,33 % ja 66,66 % 'p'-merkki.
- Molekyyleillä, joilla on kolmion muotoinen tasomainen muoto, on keskusatomi, joka on kytketty kolmeen muuhun atomiin ja on sp2hybridisoitunut. Booriyhdisteet ovat esimerkkejä.
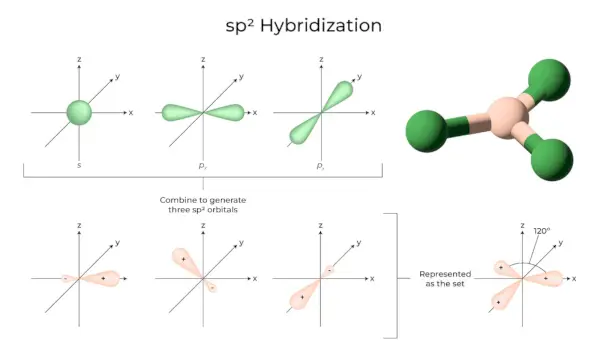
sp3Hybridisaatio
Kun yksi 's'-orbitaali ja kolme 'p'-orbitaalia samasta atomin kuoresta muodostavat neljä uutta vastaavaa orbitaalia, hybridisaatio tunnetaan nimellä tetraedrihybridisaatio tai sp.3. Äskettäin muodostuneet kiertoradat tunnetaan nimellä sp3hybridiradat. Ne on suunnattu säännöllisen tetraedrin neljään kulmaan ja muodostavat 109°28′ kulman keskenään.
- Sp3hybridiorbitaalit muodostavat 109,28 asteen kulman.
- Jokaisella hybridiradalla on 25 % s-merkki ja 75 % p-merkki.
- Etaani ja metaani ovat kaksi esimerkkiä.
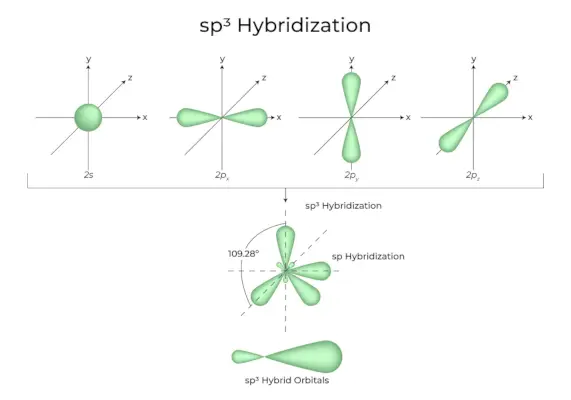
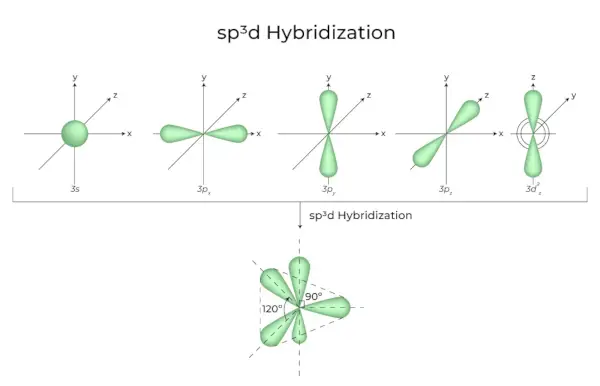
sp3d Hybridisaatio
1s-orbitaalien, 3p-orbitaalien ja 1d-orbitaalien sekoittuminen johtaa 5 sp3d-hybridisoituun orbitaaliin, joilla on sama energia. Niiden geometria on trigonaalinen bipyramidi. S-, p- ja d-orbitaalien yhdistelmä johtaa trigonaaliseen bipyramidaaliseen symmetriaan. Päiväntasaajan orbitaalit ovat kolme hybridiorbitaalia, jotka on suunnattu 120° kulmassa toisiinsa nähden ja sijaitsevat vaakatasossa.
- Loput kaksi orbitaalia, jotka tunnetaan nimellä aksiaaliradat, ovat pystytasossa 90 asteen tasossa ekvatoriaalisten orbitaalien tasossa.
- Hybridisaatio esimerkiksi fosforipentakloridissa (PCl5).
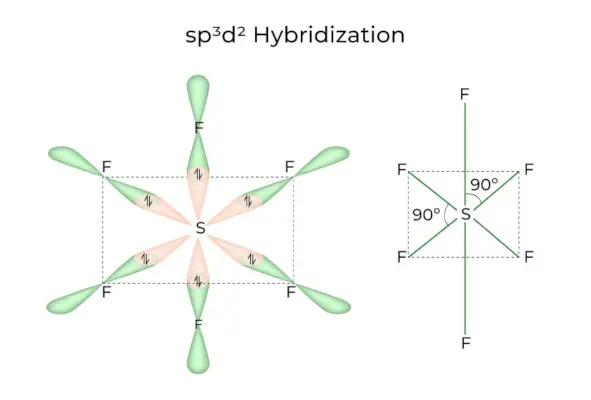
sp3d2 Hybridisaatio
Kun 1s, 3p ja 2d orbitaalit yhdistyvät muodostaen 6 identtistä sp3d2hybridiorbitaaleja, hybridisaatiota kutsutaan sp3d2Hybridisaatio. Nämä seitsemän kiertorataa osoittavat oktaedrin kulmiin. Ne ovat vinossa 90 asteen kulmassa toisiinsa nähden.
palautustyyppi javassa
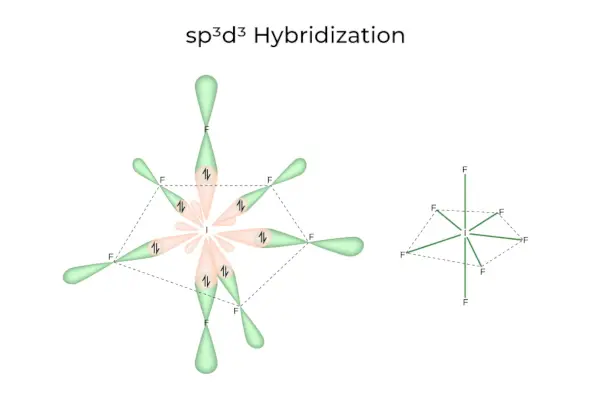
sp3d3Hybridisaatio
Siinä on 1s, 3p ja 3d orbitaalit, jotka yhdistyvät muodostaen 7 identtistä sp3d3hybridiradat. Nämä seitsemän kiertorataa osoittavat viisikulmaisen bipyramidin kulmiin. esim. JOS6.
Hybridisaation muodot
- Lineaarinen: Sp-hybridisaation aiheuttaa kahden elektronin ryhmien vuorovaikutus; ratakulma on 180°. Trigonaalinen taso: Mukana on kolme elektroniryhmää, mikä johtaa sp2hybridisaatio; orbitaalit ovat 120° etäisyydellä toisistaan. Tetraedri: Mukana on neljä elektroniryhmää, mikä johtaa sp3hybridisaatio; kiertoratakulma on 109,5°. Trigonaalinen bipyramidaalinen: Mukana on viisi elektroniryhmää, mikä johtaa sp3d hybridisaatio; ratakulmat ovat 90° ja 120°. Oktaedri: Mukana on kuusi elektroniryhmää, mikä johtaa sp3d2hybridisaatio; orbitaalit ovat 90° etäisyydellä toisistaan.
Usein kysytyt kysymykset päällä Hybridisaatio
Kysymys 1: Mikä hybridirata on elektronegatiivisempi sp:n, sp2:n ja sp3:n joukosta?
Vastaus:
S-merkin prosenttiosuus sp, sp2, ja sp3hybridisoitua hiiltä on 50 %, 33,33 % ja 25 %. S-kiertoradan pallomaisen muodon vuoksi ydin vetää sitä tasaisesti kaikista suunnista. Seurauksena on, että s-merkkinen hybridirata on lähempänä ydintä ja siten elektronegatiivisempi. Tämän seurauksena sp-hybridisoitu hiili on elektronegatiivisin.
Kysymys 2: Mitä ovat hybridiorbitaalit?
Vastaus:
Hybridiorbitaalit muodostuvat yhdistämällä tavanomaisia atomikiertoradat ja tuloksena on uusien atomiorbitaalien muodostuminen.
Kysymys 3: Mitkä ovat hybridisaation viisi muotoa?
Vastaus:
Lineaarinen, trigonaalinen tasomainen, tetraedrinen, trigonaalinen bipyramidi ja oktaedri ovat hybridisaation viisi perusmuotoa.
Kysymys 4: Miksi amidimolekyyli näyttää sp3hybridisoitunut, mutta on sp2?
Vastaus:
parseint java
Jos atomi on joko kahden tai useamman p-orbitaalin ympäröimä tai siinä on yksittäinen pari, joka pystyy hyppäämään p-kiertoradalle, yleinen hybridisaatioprosessi muuttuu. Tämän seurauksena amidimolekyylin tapauksessa yksinäinen pari menee p-kiertoradalle, mikä johtaa kolmeen vierekkäiseen rinnakkaiseen p-orbitaaliin.
Kysymys 5: Mikä on Bentin sääntö?
Vastaus:
Molekyylissä lukuisiin ryhmiin liitetty keskusatomi hybridisoituu, jolloin orbitaalit, joilla on enemmän s-merkkiä, suuntautuvat elektropositiivisiin ryhmiin ja orbitaalit, joilla on enemmän p-merkkiä, suuntautuvat elektronegatiivisiin ryhmiin.
