Atomiradat , jotka ovat matemaattisia funktioita, kuvaavat elektronien (tai elektroniparien) aaltokäyttäytymistä atomissa. Atomiradat ovat eri muotoisia tyypin mukaan. Atomiratojen eri muodot kuvaavat, että on joko suurin tai nolla todennäköisyys löytää elektroni ytimen ympäriltä joihinkin suuntiin. Orbitaaleja on neljää tyyppiä, joista jokaisella on erilainen muoto ja joita edustavat kirjaimet s, p, d ja f. S- ja p-orbitaalit huomioidaan, koska ne ovat runsaimpia kemiallisessa ja biologisessa kemiassa. An s-orbitaali sen keskellä on pallomainen ydin, a p-orbitaali on käsipainon muotoinen ja neljä viidestä d kiertoradat ovat apilanlehden muotoisia. Viides d-orbitaali on muotoiltu kuin pitkä käsipaino, jonka keskellä on donitsi. Atomin kiertoradat on järjestetty kerroksiksi tai elektronikuoriksi.
Mitä ovat atomikiertoradat?
Atomiradat ovat atomin ytimen lähellä oleva kolmiulotteinen tila, jossa elektronin löytämisen mahdollisuus on suurin.
Kvanttiatomimallin mukaan atomilla voi olla ääretön määrä kiertoratoja. Nämä kiertoradat voidaan luokitella niiden koon, muodon tai suunnan perusteella. Kapeampi kiertorata tarkoittaa, että on parempi todennäköisyys saada elektroni kiinni ytimen läheltä. Orbitaaliaaltofunktio tunnetaan usein matemaattisena funktiona, jota käytetään ilmaisemaan elektronin koordinaatit. Elektronin paikantamisen todennäköisyys esitetään kiertoradan aaltofunktion neliönä. Tämä aaltofunktio auttaa myös rajapintakaavioiden luomisessa.
Orbitaaliaaltotoiminto
The kvanttiatomimalli ennustaa, että atomilla voi olla valtava valikoima orbitaaleja. Nämä kiertoradat voidaan ryhmitellä koon, geometrian tai kaltevuuden mukaan. Pienentynyt kiertoradan koko lisää todennäköisyyttä saada elektroni lähellä ydintä. Matemaattista funktiota, jota käytetään edustamaan elektronin koordinaatteja, kutsutaan nimellä orbitaaliaaltofunktio . Elektronin löytämisen todennäköisyys esitetään kiertoradan aaltofunktion neliönä.
Voimme myös käyttää tätä aaltofunktiota rajapintakaavioiden luomiseen. Pystymme ymmärtämään orbitaalien muodon paremmin käyttämällä rajapintakaavioita vakiotodennäköisyystiheydestä eri kiertoradalle.
java trimmausmerkkijono
Atomiratojen muodot
Atomiratojen muodot vaihtelevat. Toisin sanoen niiden kuvaamien ytimen ympärillä olevien elektronien todennäköisyysjakaumat ovat erilaisia. Se tosiasia, että eri kiertoradalla olevat elektronit sijaitsevat todennäköisesti eri alueilla emoytimen ympärillä ja kokevat siten jälkimmäisen vetovoiman vaihtelevin vahvuuksin, on yksi syistä, miksi kiertoradat vaihtelevat energialtaan. On hämmästyttävää, että kaikilla vetyatomin tietyn kuoren kiertoradoilla on sama energia, vaikka niillä on erilaisia muotoja. Tämä johtuu erilaisten energiaan liittyvien maksujen poistamisesta.
Mutta heti kun on toinen elektroni, rappeutuminen katoaa.
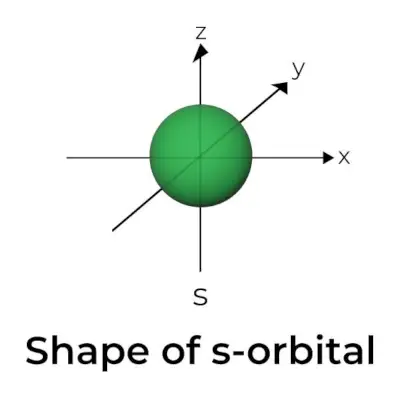
S-orbitaalin muoto
- S kiertoradan rajapintakaavio muistuttaa palloa, jonka keskellä on ydin, joka voidaan esittää kahdessa ulottuvuudessa ympyränä.
- s-orbitaalit ovat pallosymmetrisiä, mikä tarkoittaa, että todennäköisyys löytää elektroni tietyltä etäisyydeltä on sama kaikkiin suuntiin.
- Myös s-orbitaalin koon osoitetaan kasvavan ensisijaisen kvanttiluvun (n) arvon kasvaessa; siis 4s> 3s> 2s> 1s.
- Solmupiste on paikka, jossa ei ole mahdollisuutta paikantaa elektronia. Solmut luokitellaan kahteen tyyppiin: radiaaliset solmut ja kulmasolmut. Etäisyys ytimestä lasketaan säteittäisten solmujen avulla, kun taas suunnan määrittävät kulmasolmut.
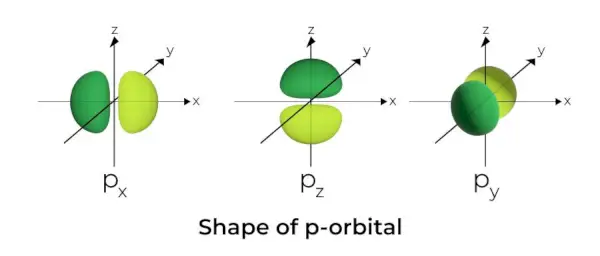
p-Orbitaalin muoto
- P-orbitaalit muodostuvat käsipainoiksi.
- P-orbitaalinen solmu sijaitsee ytimen keskustassa.
- Kolmen kiertoradan läsnäolon vuoksi p-orbitaali voi varata enintään kuusi elektronia.
- Jokainen p-orbitaali koostuu kahdesta osasta, jotka tunnetaan nimellä keilat, jotka sijaitsevat ytimen poikki kulkevan tason kummallakin puolella.
- Jokaisella p-kiertoradalla on ytimen poikki kulkevan tason kummallakin puolella tunnetut lohkot. Tasossa, jossa kaksi keilaa leikkaavat, elektronin löytämisen todennäköisyys on nolla.
- Kolme orbitaalia tunnetaan rappeutuneina kiertoradoina, koska niillä on sama koko, muoto ja energia.
- Ainoa ero orbitaalien välillä on keilojen suunta. Koska keilat ovat suunnattu x-, y- tai z-akselia pitkin, niille annetaan nimet 2px, 2py, ja 2pz. Solmujen lukumäärän laskemiseen käytetään kaavaa n –2.
- Samoin kuin s-orbitaalien, p-orbitaalien koko ja energia kasvavat ensisijaisen kvanttiluvun kasvaessa (4p> 3p> 2p).
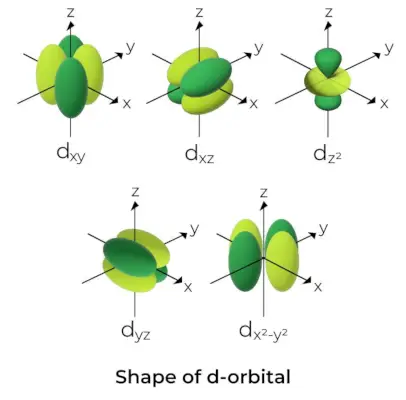
D-Orbitaalin muoto
- D-orbitaaleille magneettiratakvanttiluku annetaan muodossa (-2,-1,0, 1,2). Tämän seurauksena voimme väittää, että d-orbitaalia on viisi.
- Nämä kiertoradat on merkitty symboleilla dxy, dyz, dxz, dx2-ja2ja dKanssa2.
- Neljän ensimmäisen d-orbitaalin muodot ovat keskenään samanlaisia, mikä eroaa d:stäKanssa2orbitaali, mutta kaikkien viiden d-orbitaalin energia on sama.
f-Orbitalin muoto
- F-orbitaalin muoto on hajallaan. Koska f-orbitaalin arvo l=3, ensisijaisen kvanttiluvun n minimiarvo on 4.
- F-orbitaalin vastaavat ml-arvot ovat (-3, –2, –1, 0, +1, +2, +3).
- Tuloksena on seitsemän f-orbitaalia arvolle l = 3.

avaa asetusvalikko
Degeneroituneet kiertoradat
Degeneroituneet orbitaalit ovat niitä, joilla on sama energia. Nämä kiertoradat ovat erillisiä (ne voivat olla eri tavoin suunnattuja ympärillä olevassa tilassa atomiydin ), mutta niillä on sama energia. Ulkoisen kentän läsnä ollessa p-orbitaalin rappeutuminen ei vaikuta; f- ja d-orbitaalien rappeutuminen voidaan kuitenkin katkaista kohdistamalla järjestelmään ulkoinen kenttä (joko sähkö- tai magneettikenttä).
Harvalla kiertoradalla on korkeampi energia, kun taas toisilla on pienempi energia. Degeneraatiota ei enää ole järjestelmässä. Esimerkiksi d-orbitaalit koostuvat viidestä degeneroituneesta orbitaalista, joilla kaikilla on sama energia.
Lue lisää:
- Molekyyliratateoria
- Orbitaalin täyttö atomissa
- Hybridisaatio
Usein kysyttyä atomikiertoradan muodoista
Kysymys 1: Kuinka orbitaalit toimivat?
Vastaus:
tiedon louhinta
Atomiorbitaali on matemaattinen lauseke, joka ilmaisee yhden elektronin tai elektroniparin aaltomaista käyttäytymistä atomissa atomiteoriassa ja kvanttimekaniikassa. Jokainen orbitaali ottaa korkeintaan kaksi elektronia, joista jokaisella on oma spinin määrä.
Kysymys 2: Mikä on solmutaso?
Vastaus:
Tasoa, jossa elektronin löytämisen todennäköisyys on mitätön tai nolla, kutsutaan solmutasoksi.
Kysymys 3: Kuinka monta orbitaalia on?
Vastaus:
Koska s-alatasolla on vain yksi orbitaali, vain kaksi elektronia voi olla läsnä. Koska p-alataso käsittää kolme orbitaalia, elektroneja voi olla enintään kuusi. Koska d-alataso käsittää 5 orbitaalia, elektroneja voi olla enintään 10. Ja jokaisella neljästä alatasosta on seitsemän kiertorataa, jotka voivat sisältää enintään 14 elektronia.
kuinka poistaa sarake postgresqlissa
Kysymys 4: Millä kiertoradoilla on suurin energia?
Vastaus:
c#-kytkin
Orbitaalilla 1 on eniten energiaa. Elektronin energia on energiamäärä, joka tarvitaan sen saamiseen pois atomin sähkökuplasta.
Kysymys 5: Mitä eroa on kuorella ja orbitaalilla?
Vastaus:
Atomissa kuori on kokoelma saman kvanttilukuteorian, n, osakuoria. Jokaisella kiertoradalla on kaksi elektronia, ja samalla kiertoradalla olevilla elektroneilla on sama koon, kulmamomentin koon ja magneettisen kvanttiluvun määritelmä.
Kysymys 6: Mikä on sigma- ja pi-sidos?
Vastaus:
Atomiradan päällekkäisyys luo sigma- ja pi-sidoksia. Sigma-sidokset syntyvät limittäin olevilla atomiradan keiloilla, kun taas Pi-sidoksia syntyy, kun yksi atomiorbitaalikeila limittyy toisen kanssa.
