Emäs on kemiallinen yhdiste, joka koostuu OH:sta–ioneja ja hyväksyy protoneja. Emäs kemiassa ovat yhdisteitä, jotka muuttuvat punaisiksi lakmussinisiksi ja reagoiessaan hapon kanssa ne neutraloivat reaktion, jolloin saadaan suolaa ja vettä. Emäksen pH-arvo on suurempi kuin 7. Emäkset ovat maultaan karvaita ja kosketukseltaan liukkaita. Veteen liukenevia emäksiä kutsutaan alkaleiksi. Esimerkkejä emäksistä ovat metallioksidit, metallihydroksidit jne. Saippua on esimerkki pohjasta, jota käytämme jokapäiväisessä elämässä. Tässä artikkelissa opimme yksityiskohtaisesti emästen määritelmästä, ominaisuuksista ja kemiallisista reaktioista.

Perusmääritelmä
Emäs määritellään kemialliseksi yhdisteeksi, jonka pH-arvo on suurempi kuin 7, ottaa vastaan protonin, neutraloi hapon ja muuttaa punaisen lakmuksen siniseksi. Yleensä ne vapauttavat OH:ta–ioni dissosiaatioon. Esimerkkejä ovat NaOH, NaHCO3,jne. Seuraavassa on joitain yleisiä ominaisuuksia, jotka tukiasema näyttää:
- Niillä on kitkerä maku
- Ne ovat liukkaita kosketuksessa
- Ne muuttuvat Punaisen lakmussinisiksi
- Ne vapauttavat OH:n–ioni veteen liuotettuna
- Ne johtavat sähköä liuosmuodossa
Emäkset ovat yksi tärkeimmistä jokapäiväisessä elämässä käytetyistä kemiallisista yhdisteistä. Emäksiä käytetään antasidina happamuuden hallintaan ja hammastahnassa neutraloimaan bakteerien toimintaa, joka tuottaa happoa suussamme ja estää kiilteen ja ontelon hajoamisen. Niitä käytetään myös leivinjauheena, ruokasoodana ja pesujauheena.
10 / 50,00
Lewisin tukikohta
Lewisin emäkset ovat yhdisteitä, joissa on elektronipari ja ne voivat luovuttaa sen yhdisteille, joista puuttuu elektroniparit. Lewis-emäkset ovat luonteeltaan nukleofiilisiä, eli ne rakastavat ytimiä, mikä tarkoittaa, että ne hyökkäävät positiivisesti varautuneeseen keskustaan elektroniparillaan. Esimerkkejä Lewis Basesta ovat ammoniakki, koska ammoniakissa (NH3) Keskiatomissa Typessä on 5 elektronia, joista 3 käytetään sidoksissa 3 vetyatomin kanssa ja yksi elektronipari jää N-atomiin, jolloin muodostuu NH3Lewisin tukikohta.
Arrheniuksen tukikohta
Arrheniuksen konseptin mukaan emäkset ovat yhdisteitä, jotka vapauttavat hydroksidi-ioneja veteen liuotettuna ja lisäävät hydroksyyli-ionien pitoisuutta vesiliuoksessa. Esimerkiksi, kun KOH liuotetaan veteen, se antaa OH:ta–ioni ja siten lisäävät OH:n pitoisuutta–vedessä.
Bronstedin tukikohta
Bronsted Concept of Base on edistynyt versio Arrheniuksen konseptista, jonka mukaan emäkset ovat yhdisteitä, jotka hyväksyvät H:n.+ioni tai protoni muodostamaan konjugaattihapponsa. Esimerkiksi Cl–on perusta, joka hyväksyy H+muodostamaan HCl:n konjugaattihappokseensa.
Pohjien tyypit
Emäkset voidaan luokitella happamuuden, pitoisuuden ja ionisaatiokyvyn perusteella. Luokitus on mainittu alla
Happoisuuteen perustuvat emästyypit
Emäksen happamuus viittaa yhdessä emäsmolekyylissä olevien korvattavien hydroksyyliryhmien lukumäärään. Happamuuden perusteella emäkset luokitellaan kolmeen luokkaan:
- Monohappoinen emäs
- Diasidinen emäs
- Kolmihappoinen emäs
Monohappoinen: Monohappamat emäkset ovat emäksiä, jotka sisältävät vain yhden korvattavan hydroksyyli-ionin ja ovat vuorovaikutuksessa vain yhden vety-ionin kanssa. Monohappoisia emäksiä ovat NaOH, KOH ja muut.
Diacid: Diahappoemäs on emäs, jossa on kaksi vaihdettavaa hydroksyyli-ionia, jotka ovat vuorovaikutuksessa kahden vetyionin kanssa. Ca(OH)2, Mg(OH)2ja muut kaksihapot emäkset ovat esimerkkejä.
Kolmihappoinen: Trihappoemäs on eräänlainen emäs, joka sisältää kolme vaihdettavaa hydroksyyli-ionia ja kolme vety-ionia. Trihappoisia emäksiä ovat Al(OH)3, Fe(OH)3, ja muut.
Emästyypit, jotka perustuvat niiden pitoisuuteen vesiliuoksessa
Konsentraatio viittaa vesiliuoksessa olevan emäksen määrään. Vesiliuoksessa olevan pitoisuuden perusteella emäkset jaetaan kahteen luokkaan:
- Tiivistetty pohja
- Laimennettu pohja
Tiivistetty pohja: Väkevät emäkset ovat niitä, joissa emäksen määrä on suuri verrattuna liuottimeen. Esimerkiksi väkevä NaOH-liuos.
Laimennettu pohja: Tämän tyyppisillä emäksillä on pienempi emäspitoisuus niiden vesiliuoksessa. Laimennus on prosessi, jossa vähennetään liuenneen aineen prosenttiosuutta lisäämällä liuotinta. Esimerkiksi laimenna NaOH, laimea KOH ja niin edelleen.
Emästyypit ionisaatioasteen perusteella
Ionisaatioaste viittaa kemiallisen yhdisteen kykyyn vapauttaa ioninsa, kun se liuotetaan veteen. Emäksen tapauksessa ionisaatioaste viittaa emäksen kykyyn vapauttaa OH:ta–ioneja, kun ne ovat liuenneet veteen. Ionisaatioasteen perusteella emäkset luokitellaan kahteen tyyppiin:
- Vahva pohja
- Heikko pohja
Vahva pohja: Vahvat emäkset ovat emäksiä, jotka dissosioituvat täysin ja vapauttavat OH-ioneja veteen liuotettuna. Joitakin esimerkkejä vahvoista emäksistä ovat NaOH, KOH jne.
Heikko pohja: Emäksiä, jotka eivät käy läpi täydellistä dissosiaatiota ja jotka vapauttavat vain osan OH-ionista, kutsutaan heikoksi emäkseksi. Esimerkkejä heikoista emäksistä ovat Al(OH)3,Cu(OH)2,jne.
Lisätietoja, Vahvat ja heikot emäkset
Pohjien ominaisuudet
Kuten tiedämme, emäkset ovat kemiallisia yhdisteitä, joissa on OH-ioneja, jotka muuttuvat punaisiksi lakmussinisiksi jne. Tässä osiossa opimme emästen fysikaalisista ja kemiallisista ominaisuuksista sekä lyhyen tiedon niiden yleisistä ominaisuuksista.
Pohjan yleiset ominaisuudet
Basesin yleiset ominaisuudet mainitaan alla:
- Hydroksidi-ioni (OH–) vapautuu veteen emästen vaikutuksesta. Mitä vahvempi emäs muuttuu, mitä enemmän ioneja vapautuu.
- Emäkset reagoivat hapon kanssa muodostaen suolaa Hapot reagoivat emästen kanssa. Tätä emäksen reaktiota hapon kanssa kutsutaan neutralointireaktioksi.
- Pohjat muuttavat punaisen lakmuksen siniseksi.
- Proteiinin rakennetta voidaan muuttaa emäksillä. Pohjat ovat tätä laatua, mikä saa ne tuntumaan liukkailta. Saippua on pohja, josta tulee uskomattoman liukas iholla märkänä. Jotkin voimakkaat emäkset ovat erittäin vaarallisia, koska ne pystyvät muokkaamaan proteiinien rakennetta.
Emästen fyysiset ominaisuudet
Pohja maistuu kitkerältä: Pohja on maultaan kitkerä. Sen katkeruuden vuoksi meillä on vain vähän emäksisiä ruokia. Emäksisiä ruoka-aineita on vain vähän. Emäksiä tulee maistaa varovaisemmin kuin happoja.
Pohjat ovat liukkaita kosketuksessa: Kosketettaessa pohjat tuntuvat liukkailta. Esimerkiksi saippuaa.
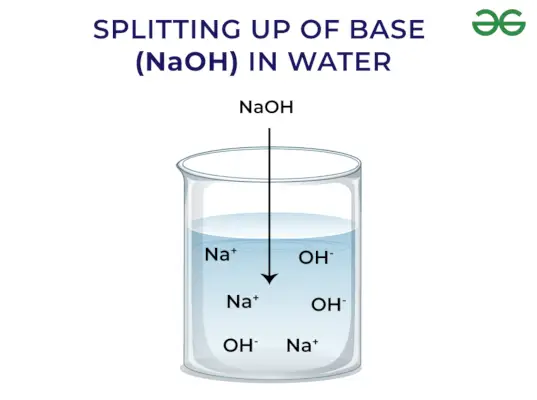
Emäkset vapauttavat OH:ta – Ioni: Kun emäkset liuotetaan veteen, ne vapauttavat hydroksyyli-ioneja (OH–). Riippuen kyvystä vapauttaa hydroksyyli-ioneja, ne luokitellaan vahvoiksi ja heikoiksi.
Emäkset neutraloivat happoja: Kun emäkset reagoivat happojen kanssa, ne neutraloivat toisensa ja tuottavat suolaa ja vettä. Tätä reaktiota kutsutaan Neutralointireaktio . Oletetaan, että meillä on happo HY ja emäs 'XOH', jolloin muodostuva suola on 'XY'. Tämän reaktion yhtälö voidaan antaa muodossa HY + XOH → HOH + XY.
muuta lisää sarake oraakkeli
Denaturoidun proteiinin emäkset: Proteiinin denaturaatio tarkoittaa proteiinin stabiilisuuden ja rakenteen tuhoamista. Tämä hyödyntää ihmisille haitallista emästä, koska ihmisen iho ja hiukset koostuvat proteiineista ja kun käytetään vahvoja emäksiä, kuten natrium- tai kaliumhydroksidia, jota kutsutaan myös lipeäksi, ne vaikuttavat haitallisesti ihmisen ihoon.
Pohjat muuttavat punaisen lakmuksen siniseksi: Kun pohjat saatetaan kosketuksiin punaisen lakmuksen kanssa, ne muuttavat sen siniseksi. On kuitenkin huomattava, että tällaista muutosta ei voida havaita, kun yritämme reagoida kuivan pohjan kanssa punaisen lakmuspaperin kanssa. Lakmuspaperitesti on yksi vanhimmista menetelmistä testata perustaa. On kuitenkin olemassa myös muita indikaattoreita, kuten fenolftaleiini
Pohjat johtavat sähköä: Kun emäkset ovat liuosmuodossa, niissä on liikkuvaa OH-ionia, joten ne voivat johtaa sähköä.
Emästen kemialliset ominaisuudet
- Emäksen reaktio metallien kanssa: Kun alkali (emäs) reagoi metallin kanssa, muodostuu suolaa ja vetykaasua.
Alkali + metalli → suola + vety
Esimerkkejä:
- Kun natriumhydroksidi on vuorovaikutuksessa alumiinimetallin kanssa, syntyy natriumaluminaattia ja vetykaasua.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Kun natriumhydroksidi on vuorovaikutuksessa sinkkimetallin kanssa, se tuottaa vetykaasua ja natriumsinkaattia.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Ei-metallisten oksidien reaktio emäksen kanssa: Suolaa ja vettä muodostuu, kun ei-metalliset oksidit reagoivat emäksen kanssa.
Ei-metallinen oksidi + emäs → suola + vesi
Kun kalsiumhydroksidi, emäs saatetaan reagoimaan hiilidioksidin kanssa, jolloin muodostuu kalsiumkarbonaattia ja vettä.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Alkalien/emäksen reaktio ammoniumsuolojen kanssa: Ammoniakkia syntyy, kun alkalit reagoivat ammoniumsuolojen kanssa.
Alkali + ammoniumsuola → suola + vesi + ammoniakki
Kun kalsiumhydroksidi reagoi ammoniumkloridin kanssa, syntyy kalsiumkloridivettä ja ammoniakkia.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Esimerkkejä pohjasta
Emäkset ovat yleensä metallioksidia, metallihydroksidia, metallivetykarbonaattia, metallikarbonaattia jne. Katsotaanpa joitain esimerkkejä emäksistä ja niiden sovelluksesta taulukkomuodossa:
| Pohjat | Sovellukset |
|---|---|
| Kaliumhydroksidi KOH | Käytetään alkaliparistoissa |
| Natriumhydroksidia NaOH | Käytetään saippuan ja pesuaineen valmistuksessa |
| Magnesiumhydroksidi Mg(OH) 2 | Käytetään antasideina |
| Natriumbikarbonaatti NaHCO 3 tallennettu ohjelman ohjaus | Käytetty ruokasoodana |
| Sooda Jo 2 CO 3 | Käytetty pesusoodana |
| Ammoniakki NH 3 | Käytetään puhdistus- ja lääketuotteiden valmistuksessa |
| Kalsiumhydroksidi Ca(OH) 2 | Käytetty White Washingissa |
Pohjien käyttötarkoitukset
Pohjalla on useita käyttötapauksia, joista osa on:
- Natriumhydroksidia käytetään saippuan ja paperin valmistuksessa. Natriumhydroksidia (NaOH) käytetään myös raionin valmistuksessa.
- Valkaisujauhe on valmistettu Ca(OH)2, joka tunnetaan yleisesti sammutettuna kalkina tai kalsiumhydroksidina.
- Kalsiumhydroksidia käytetään kuivaseoksien luomiseen maalausta ja koristelua varten.
- Magnesiumhydroksidi, joka tunnetaan yleisesti nimellä magnesiummaito, on laksatiivinen aine, jota käytetään laajasti. Sitä käytetään myös antasidina, koska se vähentää ylimääräistä happamuutta ihmisen mahassa.
- Laboratorioissa ammoniumhydroksidi on kriittinen reagenssi.
- Sammutettua kalkkia voidaan käyttää maaperän ylimääräisen happamuuden neutraloimiseen.
Lue lisää
- Happo, emäs ja suola
- Hapon vahvuus
- Hapon ja emäksen ionisaatio
Usein kysytyt kysymykset kemian perusteista
1. Mitä ovat emäkset?
- Perusyhdisteillä on katkera maku.
- Useimpien emästen rakenne on saippuamainen.
- Kun se testataan lakmuspaperilla, se muuttaa punaisen lakmuspaperin useimmissa tapauksissa siniseksi lakmuspaperiksi.
- Liuoksessa perusyhdisteet johtavat myös sähköä.
- Kun emäsyhdisteitä liuotetaan veteen, vapautuu OH-ioneja.
2. Mitkä ovat emästen toiminnot?
Kotona käytämme emäksiä puhdistusaineina ja antasideina. Saippuat, lipeä (jota käytetään uuninpuhdistusaineissa), magnesiummaito ja tummat ovat kaikki esimerkkejä suosituista kotitekoisista perusteista. Jokaisen niistä on pH suurempi kuin seitsemän, ne voivat kuluttaa vapaata vetyä ja neutraloida happoja.
3. Mikä on tärkein ero hapon ja emäksen välillä?
Hapot ja emäkset ovat kahdenlaisia syövyttäviä kemikaaleja. Happamien materiaalien pH-arvo on välillä 0-7, kun taas emästen pH-arvo on välillä 7-14. Hapot ovat ionisia kemikaaleja, jotka hajoavat vedessä muodostaen vetyionin (H+), kun taas emäs hajoaa muodostaen OH-ionia.
4. Mitkä ovat emästen fyysiset ominaisuudet?
- Niissä on katkera maku.
- Niiden vesiliuokset ovat saippualaatuisia.
- Ne muuttavat lakmuspaperin värin punaisesta siniseksi.
- Niiden vesiliuokset ovat sähköä johtavia.
- Vetykaasun vapautuessa emäkset reagoivat metallien kanssa muodostaen suolaa.
5. Mitä tapahtuu, kun kalsiumhydroksidi reagoi ammoniumkloridin kanssa?
Kun kalsiumhydroksidi reagoi ammoniumkloridin kanssa, syntyy kalsiumkloridivettä ja ammoniakkia.
b plus puuCa(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Mitä tapahtuu, kun natriumhydroksidi reagoi sinkkimetallin kanssa?
Kun natriumhydroksidi on vuorovaikutuksessa sinkkimetallin kanssa, se tuottaa vetykaasua ja natriumsinkaattia.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Mikä on Lewis Base?
Lewis Base ovat yhdisteitä, jotka luovuttavat elektroniparin yhdisteelle, josta puuttuu elektroni. Esimerkki sisältää NH:n3.
8. Mistä pohjat on tehty?
Emäkset koostuvat yleensä OH:sta–ioni. Näiden metallioksidien lisäksi emäksiä ovat myös karbonaatit ja vetykarbonaatit.
9. Mitä alkalit ovat?
Veteen liukenevia emäksiä kutsutaan alkaleiksi. Esimerkki on natriumhydroksidi NaOH.
10. Mitä ovat vahva ja heikko kanta?
Emäkset, jotka dissosioituvat täydellisesti muodostaen OH:ta–veteen liukenevia ioneja kutsutaan vahvaksi emäkseksi. Esimerkkejä ovat NaOH. Heikot emäkset ovat emäksiä, jotka eivät hajoa täysin vapauttaakseen OH:ta–ionia kutsutaan heikoksi emäkseksi. Esimerkkejä heikoista emäksistä ovat ammoniumhydroksidi.
