Aufbaun periaate on perusmenetelmä, joka kertoo kuinka elektronit täyttyvät atomiradalla. Aufbaun periaatteen mukaan atomin perustilassa olevien elektronien täyttyminen noudattaa perusmallia. Tämä periaate kertoo meille, että minkä tahansa atomien atomiradalla olevat elektronit täyttyvät energiansa nousevassa järjestyksessä ja atomiradan energian löytämiseksi ne noudattavat n+l-sääntöä.
Rakenneperiaate
Tässä artikkelissa opimme Aufbau-periaatteesta, Aufbau-periaatteen ominaisuuksista, sen poikkeuksista ja rajoituksista yksityiskohtaisesti.
Rakenteen periaatteen määritelmä
Aufbaun periaate sanoo sen
esimerkki javassa
Eri kiertoradalla olevat elektronit täyttyvät energiansa kasvavassa järjestyksessä, eli alhaisimman energian kiertorata täyttyy ensimmäisenä ja suurimman energian kiertorata täytetään viimeisenä.
Sana 'Aufbau' tarkoittaa saksaksi 'rakentamista'. Orbitaalien muodostuminen tarkoittaa orbitaalien täyttämistä elektroneilla. Siinä sanotaan, että atomikiertoradalla olevat elektronit täyttyvät atomiradan energian nousevassa järjestyksessä. Ja atomiradan energia lasketaan käyttämällä n+l-sääntöä, joka kertoo, onko elektronilla, jolla on suurempi määrä n+l-arvoa, suurempi energia. Edellisellä rivillä käsitellyssä säännössä n kertoo pääkvanttiluvun ja l kertoo atsimuuttikvanttiluvun.
Jos kahdella elektronilla on sama arvo n+l, niin elektronilla, jonka arvo on pienempi n sillä on pienempi energia ja se täyttyy ensin. Alla käsitellään elektronien täyttöjärjestystä atomikiertoradalla.
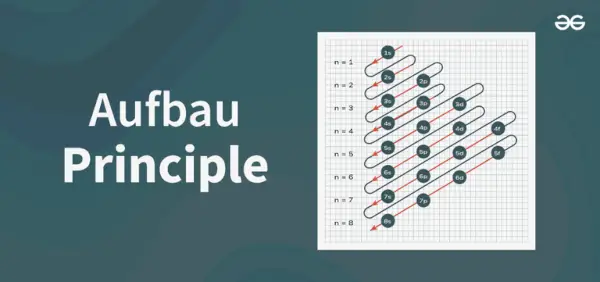
Periaatekaavion rakenne
Aufbaun periaatekaavio on kaavio, joka kuvaa atomin elektronien täyttymisjärjestystä.
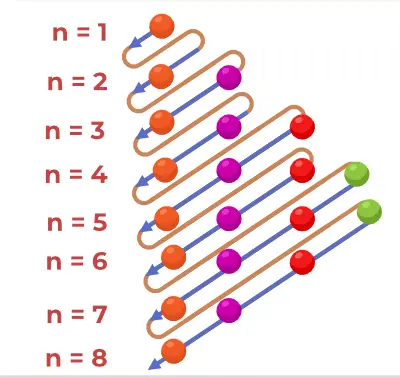
Periaatekaavion rakenne
Periaatekaavan rakenne
Aufbaun periaatekaava on kaava, joka kertoo järjestyksen, jossa elektronit täyttyvät atomiradalla. Atomiradan kaava on
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Periaateluokan 11 rakenne
Aufbaun periaate on tärkeä kemian periaate luokan 11 opiskelijoille. Tämä periaate sanoo, että
Atomin atomiradalla olevat elektronit täytetään atomiradan energian nousevassa järjestyksessä, joka lasketaan (n+l) -säännöllä.
Rakennekaavion piirtäminen
Aufbau-kaavio piirretään alla lisätyillä vaiheilla,
- Selvitä niiden elektronien lukumäärä, jotka atomeissa täytetään.
- Tiedämme, että atomissa
- s-orbitaali voi sisältää enintään 2 elektronia.
- p-orbitaali voi sisältää enintään 6 elektronia.
- d-orbitaali voi sisältää enintään 10 elektronia.
- f-orbitaali voi sisältää enintään 14 elektronia.
- Täytä kaksi ensimmäistä elektronia 1s-kiertoradalla.
- Noudata sitten n+l-sääntöä ja täytä sitten elektronit vastaavasti.
Rakenneperiaatteen keskeiset piirteet
Aufbau-periaatteen eri ominaisuuksia ovat mm.
- Orbitaalin energia riippuu pääkvanttiluvun (n) ja atsimuuttisummaluvun (I) arvojen summasta. Tätä kutsutaan (n + l) -sääntö . Tämän säännön mukaan
- Neutraalissa eristetyssä atomissa mitä pienempi arvo (n + l) orbitaalille on, sitä pienempi on sen energia. Kuitenkin, jos kahdella eri tyyppisellä kiertoradalla on sama arvo (n + l), niin kiertoradoilla, joiden arvo on pienempi n, on vähemmän energiaa.
| Orbitaalin tyyppi | Arvo n | Arvo l | Arvo n+l | Suhteellinen energia |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Alhaisin energia |
| 2s | 2 | 0 | 2+0 = 2 | Suurempi energia kuin 1s kiertoradalla |
| 2p 3s | 2 panda iterrows 3 | 1 0 | 2+1 = 3 3+0 = 3 | 2p kiertoradalla(n=2) on pienempi energia kuin 3s(n=3) orbitaalilla. |
| 3p 4s | 3 4 | 1 0 | 3+1 = 4 vertaa merkkijonossa 4+0 = 4 | 3p kiertoradalla(n=3) on pienempi energia kuin 4s(n=4) kiertoradalla. |
| 3d 4p | 3 4 | 2 1 | 3+2 = 5 4+1 = 5 | 3d-kiertoradalla(n=3) on pienempi energia kuin 4p(n=4)-orbitaaleilla. |
Taulukossa esitetystä kuvauksesta seuraa, että eri kiertoratojen energiat kasvavat pääkvanttiluvun luvun kasvaessa.
- Siten järjestys, jossa elektronit täyttyvät atomiradalla atomi On, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…
Sähköinen konfigurointi Aufbau-periaatteella
The elektroninen konfigurointi Aufbau-periaatteen käyttöä muutamille elementeille käsitellään alla:
Rikin elektronikonfiguraatio
Atominumero rikki on 16, eli siinä on 16 elektronia
Nyt käyttämällä Aufbau-periaatetta rikin elektroninen konfiguraatio kirjoitetaan seuraavasti:
[S] = 1 s 2 2s 2 2p 6 3s 2 3p 4
Typen elektronikonfiguraatio
Typen atomiluku on 7, eli siinä on 7 elektronia
Nyt käyttämällä Aufbau-periaatetta typen elektroninen konfiguraatio kirjoitetaan seuraavasti:
[N] = 1 s 2 2s 2 2p 3
Poikkeuksia rakennusperiaatteeseen
Aufbau-periaatteesta on muutamia poikkeuksia, jotka ovat kromi ja kupari. Niiden elektroninen kokoonpano on
Chromiumin sähköinen määritys
Kromin elektronisen konfiguraation Aufbau-periaatteen mukaan tulisi olla
- Cr(24): [Ar]3d 4 4s 2
Mutta yllä oleva kokoonpano ei ole oikea, koska Chromium(Cr):n todellinen elektroninen kokoonpano on
taulukon c merkkijono
- Cr(24): [Ar]3d 5 4s 1
Syy tähän elektroniseen kokoonpanoon on se, että puoliksi täytetty d-atomiorbitaali on vakaampi kuin Aufbau-periaatteen mukaisesti täytetty kiertoradalla.
Kuparin elektroninen konfigurointi
Kuparin elektronisen konfiguraation Aufbau-periaatteen mukaisesti tulisi olla,
- Cu(29): [Ar]3d 9 4s 2
Yllä oleva konfiguraatio ei ole oikea, koska kupari(Cu):n todellinen elektroninen konfiguraatio on
- Cu(29): [Ar]3d 10 4s 1
Syy tähän elektroniseen kokoonpanoon on se, että täysin täytetty d-atomiorbitaali on vakaampi kuin Aufbau-periaatteen mukaisesti täytetty kiertoradalla.
Lue lisää
- Kvanttiluvut
- Atomiorbitaalien muoto
- Atomirakenne
Rakenneperiaate – UKK
Mikä on Aufbaun periaate kemiassa?
Aufbaun periaate kemiassa on perusperiaate, jota käytetään täyttämään minkä tahansa atomin atomikiertoradalla olevat elektronit. Tämä lause kertoo meille järjestyksen, jossa elektronit täyttyvät atomiradalla.
Kuka antoi Aufbau-periaatteen?
Kuuluisa tanskalainen fyysikko Niels Bohr esitti Aufbau-periaatteen vuonna 1920.
Mikä on Paulin poissulkemisperiaate?
Paulin poissulkemisperiaate sanoo, että atomissa ei kahdella elektronilla olisi kaikki neljä kvanttilukua t hän sama. Ainakin yksi kvanttiluvuista on erilainen kaikille atomin elektroneille.
Mikä on n+l-sääntö?
Sääntö n+l on sääntö, jonka mukaan kiertoradan energia riippuu pääkvanttiluvun (n) ja atsimuuttikvanttiluvun (l) summasta. tätä sääntöä kutsutaan (n+l) säännöksi.
Mitkä ovat poikkeukset Aufbau-periaatteesta?
Poikkeus Aufbau-periaatteeseen ovat
- Chromium Cr:n elektroninen määritys[24]
- Kupari Cu:n elektroninen konfigurointi[29]
